中 国 臨 床 試 験 体 制
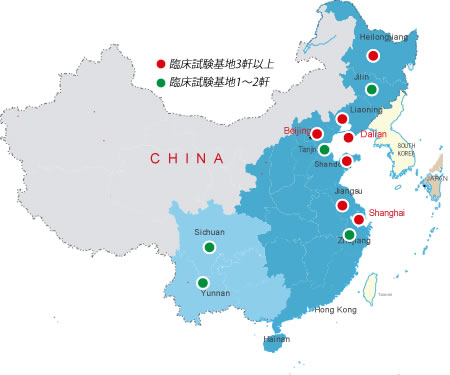
中国の規制によると、臨床試験はSFDA承認した医療機関(臨床試験基地)に実施しなければならない。当社は中国臨床試験基地と提携し、低コスト、高品質、高効率に臨床試験受託サービスを提供します。
![]()
![]()
中国臨床試験受託の市場は、医薬品・医療機器市場の拡大、低臨床試験コスト、被験者募集の安さ等により、著しく発展しています。しかし、臨床試験施設(中国では臨床試験基地という)が少なく、臨床試験関連人員の経験不足、日本新GCPと中国GCPの相違等、中国において臨床試験実施する際、スムーズに進まないことがしばしばあります。
当社は中国臨床医及び日本臨床試験・薬事申請の経験者が常駐し、日中の医療ネットワークを活かし、高品質なサービスを提供し、臨床試験を受託いたします。
中 国 臨 床 試 験 体 制

中国の規制によると、臨床試験はSFDA承認した医療機関(臨床試験基地)に実施しなければならない。当社は中国臨床試験基地と提携し、低コスト、高品質、高効率に臨床試験受託サービスを提供します。
お客様のニーズにあわせ、モニタリング、データマネジメント、薬事申請を全般又は一部をサポートいたします。
モニタリング
・臨床試験実施医療機関の選定と調査(中国、日本)
・臨床試験の依頼/治験審査委員会(IRB)申請業務
・契約手続き
・被験者募集に関する業務
・臨床試験関係者(中国)に対するGCP教育
・モニタリング業務
データマネジメント
・統計解析(立案、解析、報告書の作成)
薬事
・臨床試験実施計画書作成、治験機器概要書作成
・症例報告書(CRF)作成
・総括報告書の作成、製造販売承認申請概要作成支援、 論文作成支援
・臨床医として、クライアントへの提案が可能
・整形外科、循環器及び婦人科など多分野の臨床試験経験
・中国数多くの臨床試験基地と連携し、治験体制の構築
・新GCP及び中国GCP、日中臨床試験習慣を熟知、国際共同臨床試験受託